2024年11月4日,脑科学与康复医学研究院(脑科院)青年拔尖人才刘彦梅研究员与广东省人民医院费继锋教授、美国俄克拉荷马医学研究基金会Gaurav K. Varshney副教授作为共同通讯作者在Nature Communications 在线发表题为“Cytosine base editors with increased PAM and deaminase motif flexibility for gene editing in zebrafish”的研究论文[1]。该研究开发了针对斑马鱼的胞嘧啶碱基编辑器zevoCDA1,可以提高各种DNA背景下的编辑效率,并减少原间隔区相邻基序(PAM)的限制。该研究进一步创建了zevoCDA1-198,这是一种编辑窗口更窄的精准编辑器,能够有效降低脱靶效应。利用这些先进的工具,作者成功创建了原先难以实现的人类疾病的斑马鱼模型。该研究增强了在斑马鱼中引入人类致病突变的能力,扩大了基因组研究的范围,并提高了精确性和效率。该工作是刘彦梅团队继前期在斑马鱼中开发突破了PAM限制的胞嘧啶碱基编辑器SpRY-CBE4max、腺嘌呤碱基编辑器zSpRY-ABE8e[2]以及高效且低插入/缺失率的ABE-Umax[3]基础上的又一突破。

本研究首先在斑马鱼中引入David Liu团队利用噬菌体辅助的定向进化系统开发出的、具有靶序列背景兼容性的胞嘧啶碱基编辑器evoCDA1-BE4amx[4]。与当前最先进的斑马鱼单碱基编辑器zAncBE4max表现出明显的TC偏好性相比,evoCDA1-BE4max在个别GC/CC位点有明显提升但整体编辑效率较低(图1b)。作者进行斑马鱼密码子优化将原始evoCDA1-BE4amx改造为zevoCDA1-BE4max,其对zAncBE4max或原始的evoCDA1-BE4max无法编辑的GC和CC位点表现出高效的编辑能力,效率最高可达100%(图1b)。然而,在对基因组上33个位点的测试发现,约三分之一(12/33)的zevoCDA1-BE4max靶向区域在Sanger测序中显示出明显的套峰(图1d-f),表明zevoCDA1-BE4max在某些位点具有相对较高的插入/缺失率,仍需要进一步优化以提升编辑产物的纯度和精确度。
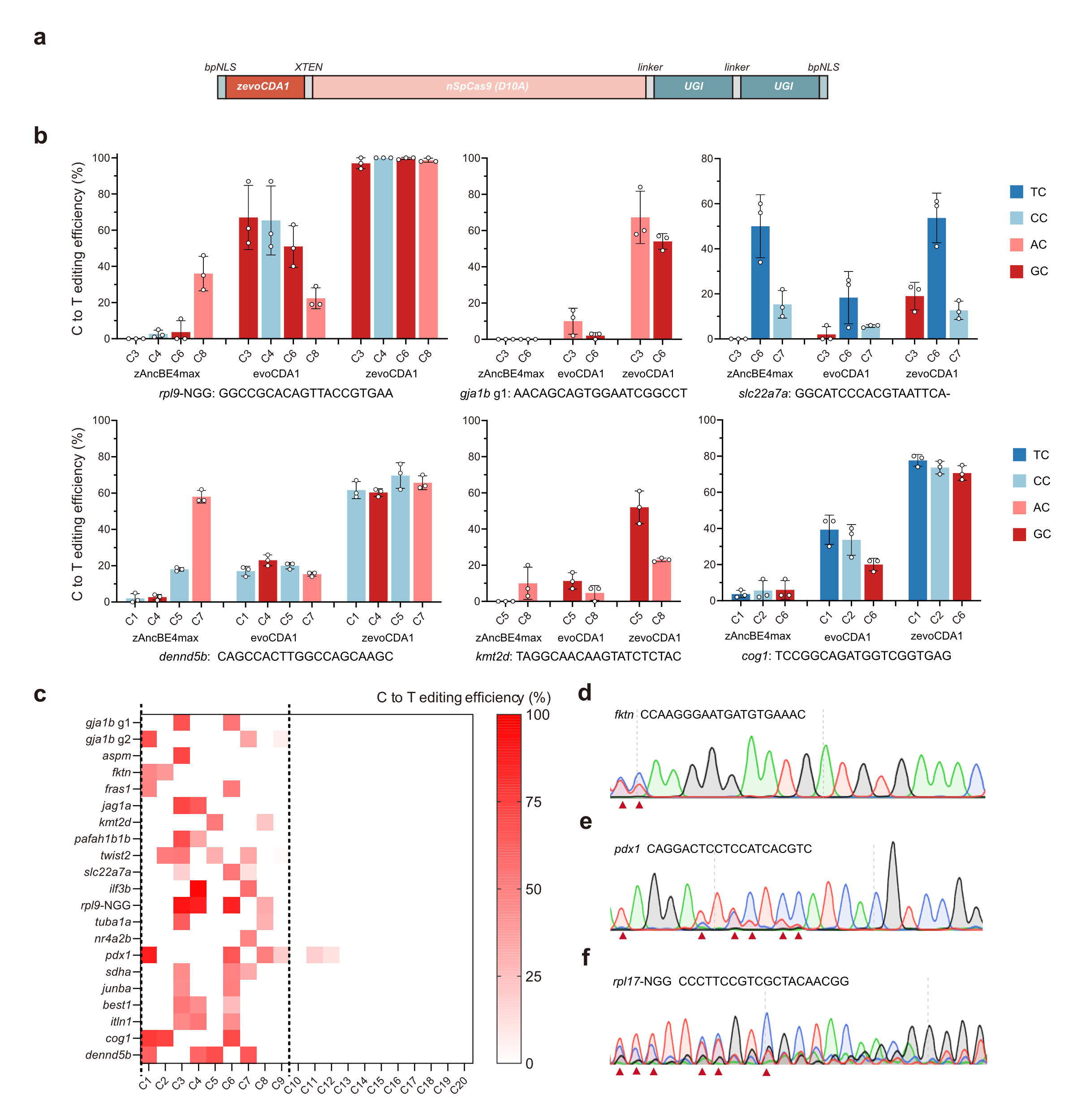
图1 zevoCDA1-BE4max在所有上下文序列背景下的胞嘧啶编辑效果
结合对PAM更加灵活的Cas9变体SpRYCas9,研究团队进一步开发了zevoCDA1-SpRY-BE4max(图2a)。与先前的SpRY-CBE4max在多个非经典PAM位点进行比对,zevoCDA1-SpRY-BE4max主要编辑窗口(Cas9目标位点PAM远端的1-9位)内几乎所有背景的C都发生了更加高效的C-T的碱基转换(图2b-d)。随后在基因组30个位点进行统计汇总,zevoCDA1-SpRY-BE4max和zevoCDA1-BE4max一样,能够对主要编辑窗口内的所有上下文序列背景的胞嘧啶实现有效编辑(图2f)。利用zevoCDA1-SpRY-BE4max,研究者创建了一个此前不曾存在的斑马鱼皮肤和眼部白化病(oculocutaneous albinism)疾病模型,而zAncBE4max和SpRY-CBE4max在该位点都没能有效编辑目标胞嘧啶。二代测序技术检测显示zevoCDA1-SpRY-BE4max造成插入/缺失率明显低于zevoCDA1-BE4max。
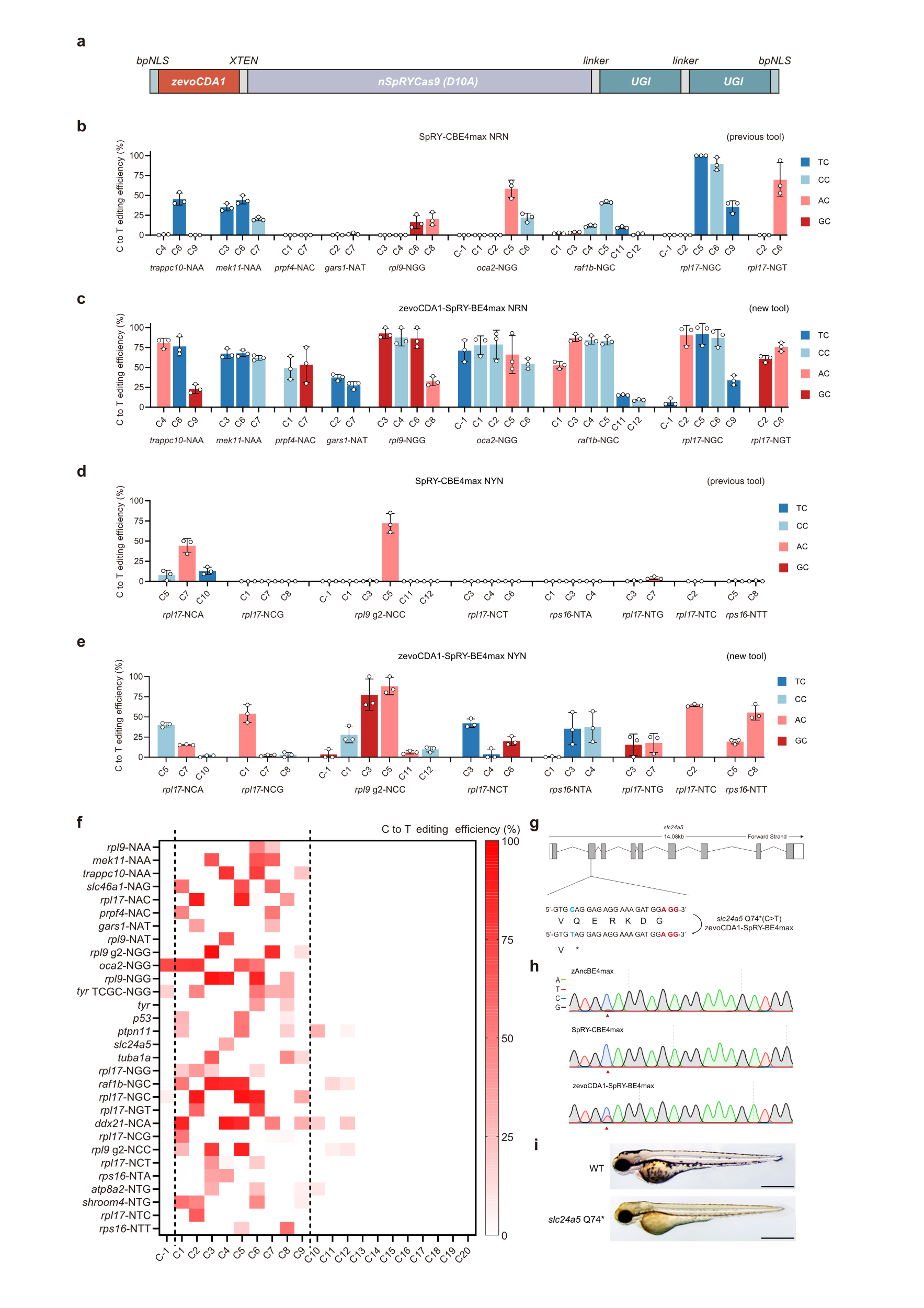
图2 zevoCDA1-SpRY-BE4max在非经典PAM位点的胞嘧啶编辑效果以及疾病造模
为了提高编辑精度,研究者删除了zevoCDA1和SpRY之间的连接序列,生成了zevoCDA1-NL(图3a)。在此基础上进一步删除了zevoCDA1-NL中zevoCDA1的核输出信号(NES)序列,生成了zevoCDA1-198(图3a)。zevoCDA1-NL和zevoCDA1-198的主要编辑窗口分别缩小到了1-7位和1-5位(图3b-e),而编辑效率与zevoCDA1-SpRY-BE4max相当。借助zevoCDA1-198,研究者成功生成了Axenfeld-Rieger综合症的精准疾病模型(图3f-k’)。二代测序技术进一步展示,与zevoCDA1-SpRY-BE4max和zevoCDA1-NL相比,zevoCDA1-198表现出较低的插入/缺失率和脱靶效应。综上,zevoCDA1-198是一种精准、高效、PAM灵活且无序列上下文偏好的胞嘧啶碱基编辑工具,为在斑马鱼中建立人类遗传疾病模型提供了更多可能。
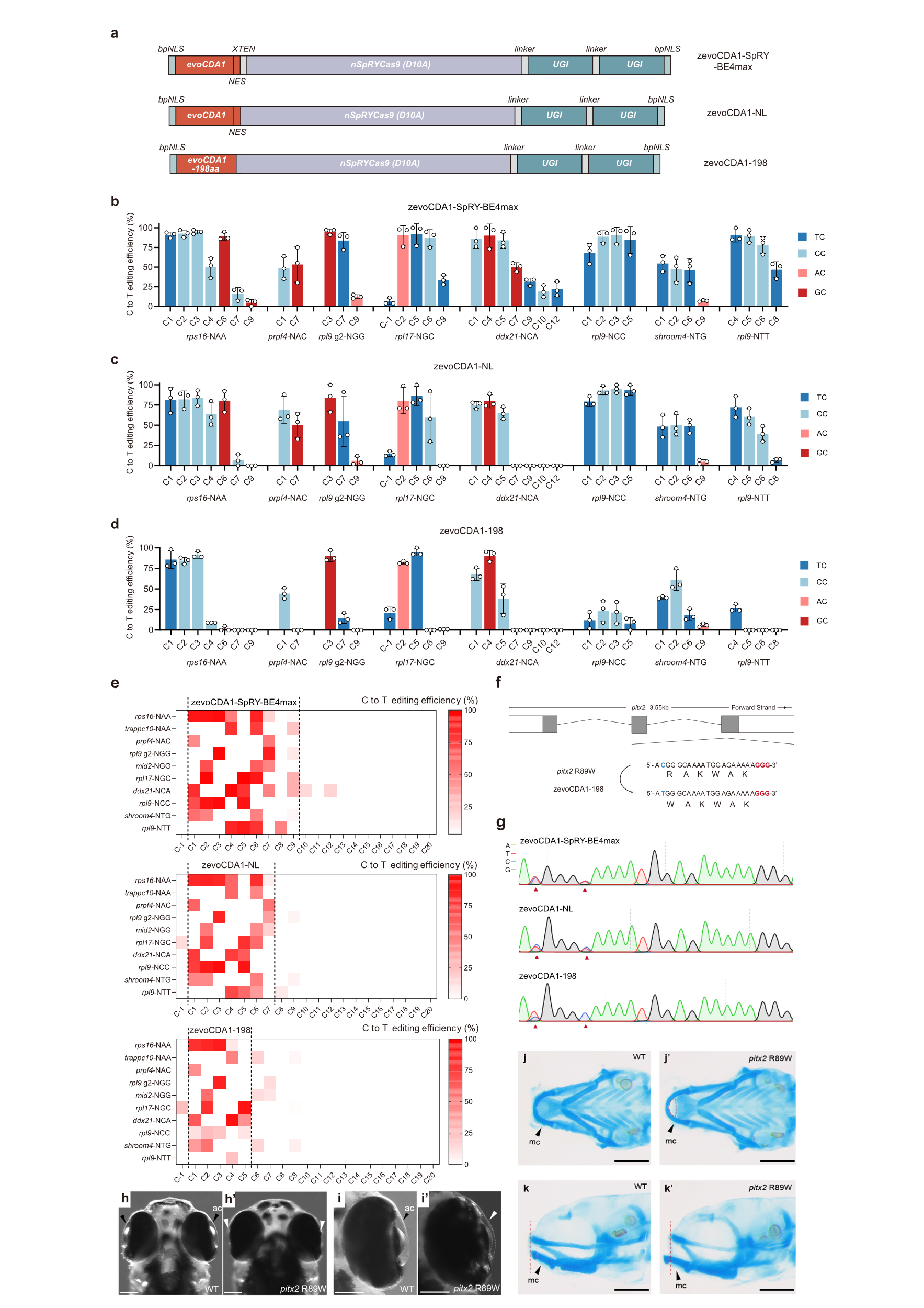
图3 zevoCDA1-NL和zevoCDA1-198精确编辑胞嘧啶碱基
综上所述,此次研究通过开发新型的胞嘧啶碱基编辑工具,显著提升了斑马鱼作为研究人类疾病模型的能力,为未来基因组研究提供了更为精确和高效的技术手段,将推动对人类疾病机制的深入理解及治疗策略的探索。
我校脑科院硕士研究生张煜、刘洋、郑少辉和原脑科院青年英才、现美国俄克拉荷马医学研究基金会博士后秦伟博士为本研究论文的共同第一作者。该研究得到了国家重点研发计划、国家自然科学基金、广东省人民医院高水平医院建设项目和俄克拉荷马医学研究基金会的支持。
原文链接:
https://url.scnu.edu.cn/record/view/index.html?key=19fc5e7f116c8a01f5919005e107cfc6
参考文献
[1] Zhang, Y., Liu, Y., Qin, W. et al. Cytosine base editors with increased PAM and deaminase motif flexibility for gene editing in zebrafish. Nat Commun 15, 9526 (2024).
[2] Liang, F. et al. SpG and SpRY variants expand the CRISPR toolbox for genome editing in zebrafish. Nat Commun 13, 3421 (2022).
[3] Qin, W., Liang, F., Lin, SJ. et al. ABE-ultramax for high-efficiency biallelic adenine base editing in zebrafish. Nat Commun 15, 5613 (2024).
[4] Thuronyi, B.W. et al. Continuous evolution of base editors with expanded target compatibility and improved activity. Nat Biotechnol 37, 1070-1079 (2019).
供稿:刘彦梅
初审:吴曦阳
复审:向杰
终审:曾礼漳