近日,脑科学与康复医学研究院青年英才张真真博士回顾了恶性脑胶质母细胞瘤的新兴疗法、新概念、新技术以及多种免疫疗法在胶质瘤治疗中的前景,于2022年4月的《J Exp Clin Cancer Res》杂志(医学一区,2021影响因子:11.16)在线发表了题为:“Emerging therapies for glioblastoma: current state and future directions”的综述论文 (DOI: 10.1186/s13046-022-02349-7)。
脑胶质瘤是指起源于脑神经胶质细胞的肿瘤,是最常见的高度侵袭性原发性颅内肿瘤,临床表现主要包括颅内压增高、神经功能及认知功能障碍和癫痫发作三大类。基于表型、基因亚型和肿瘤分级,2021 年版 WHO 中枢神经系统肿瘤分类将脑胶质瘤分为 1~4 级,1、2 级为低级别脑胶质瘤,3、4 级为高级别脑胶质瘤,以便在异质性胶质瘤患者群体中进行更客观的诊断。胶质母细胞瘤(GBM)是最恶性(4级)的胶质瘤,占所有胶质瘤的55%,其5年生存率为<5%。
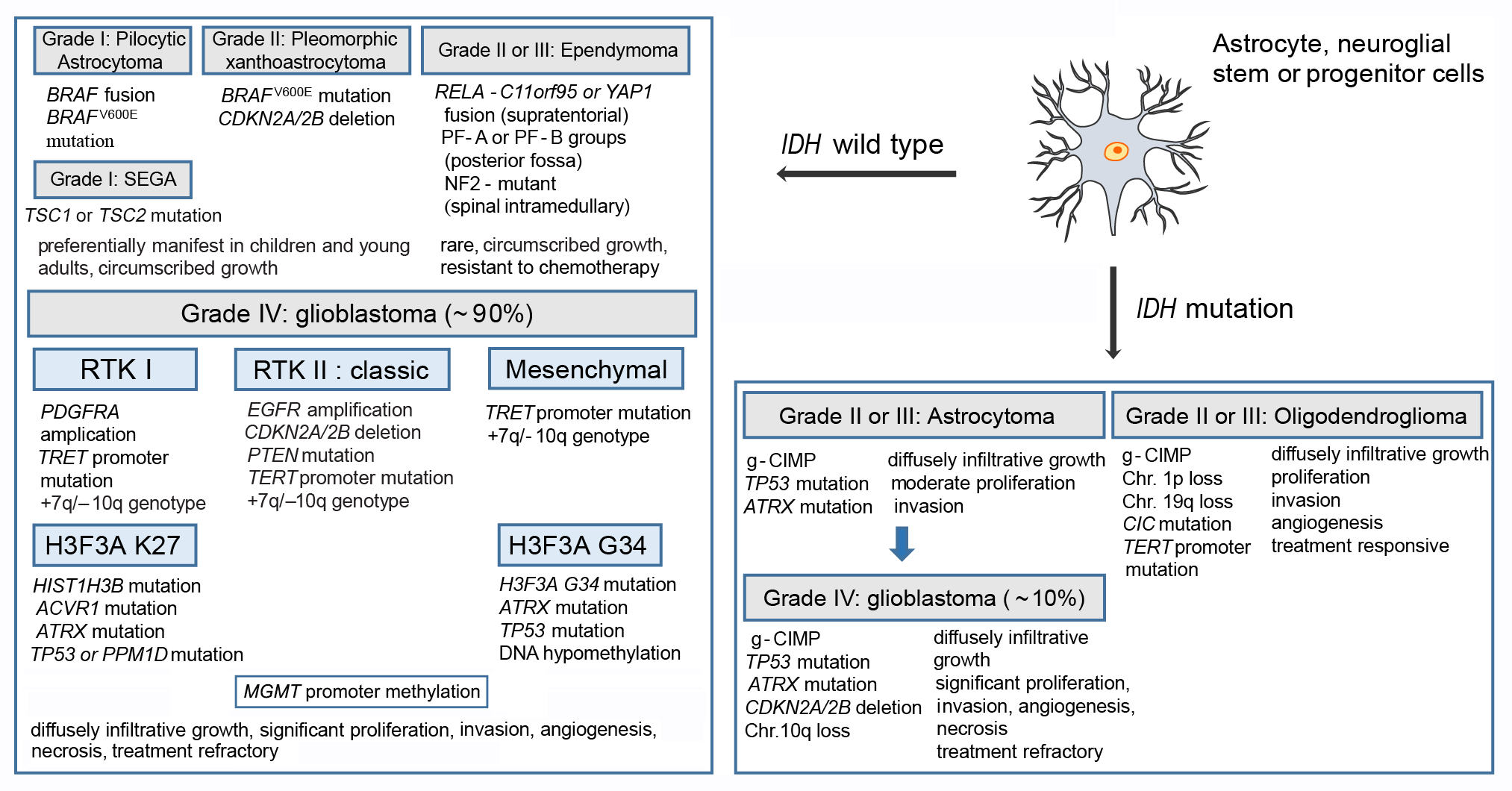
图1. 神经胶质瘤的分类
尽管在过去几十年中进行了深入的研究,但恶性胶质瘤的标准治疗仍然局限于切除和放化疗。即使是积极治疗的平均生存期通常也不到2年。目前免疫治疗在临床研究中已取得突破性进展,恶性神经胶质瘤的免疫治疗策略如下:
免疫检查点抑制剂:程序性细胞死亡蛋白(PD-1)和配体(PD-L1),以及细胞毒性T淋巴细胞相关抗原4(CTLA-4)是抑制性免疫通路中阻碍免疫反应的主要效应因子。针对PD-1、PD-L1和CTLA-4的单克隆抗体通过激活细胞毒性T淋巴细胞(CTLs)来增强抗肿瘤反应。
CAR-T治疗:嵌合抗原受体(CAR) T细胞特异性的识别不依赖于主要组织相容性复合体(MHC)暴露的肿瘤细胞;CAR-T细胞具有无限的抗原多样性,并避免肿瘤下调MHC表达的某些免疫逃避机制。由于胶质母细胞瘤存在异质性,且肿瘤微环境对CAR-T呈现免疫抑制,单一分子靶点可能不足以维持CAR-T细胞交叉靶点上高度异质性的肿瘤。因此,提高CAR-T细胞覆盖抗原的数量以及联合疗法(与免疫检查点分子抑制剂以及其他靶向疗法联合)是提高CAR-T疗效的关键。
疫苗治疗:主要包括多肽和树突状细胞疫苗,目的是通过增强抗原特异性效应T细胞对肿瘤部位的募集来诱导免疫应答。最近,新一代测序技术和生物信息学工具的进步使得系统地发现肿瘤新抗原成为可能,这些新抗原来源于肿瘤的体细胞突变,因此具有肿瘤特异性,使个性化的抗肿瘤疫苗成为可能。
溶瘤病毒:溶瘤病毒可以抑制癌细胞的复制,或改变其基因,感染或杀死肿瘤细胞;然后利用先天免疫系统,启动适应性抗肿瘤免疫反应。这种治疗策略可以打破肿瘤被微环境的束缚,使脑肿瘤由冷转热,引起强烈的免疫反应。溶瘤病毒可与免疫检查点抑制剂以及其他免疫疗法发挥协同作用,引起持久的治疗效果,在GBM治疗中联合治疗具有很大的潜力。
除此之外,靶向血管生成抑制剂和新的治疗方式(例如交替电场疗法)取得了进展,使得近年来患者存活率仅略有改善。即使目前胶质瘤的免疫治疗面临重重挑战,但作为胶质瘤重要的辅助治疗手段之一,免疫治疗也正迎来其新的机遇。随着免疫组学,基因组学和测序技术的不断发展革新,免疫疗法的研究进展迅速。同时,交替电场疗法的发展,由于其可以跨越血脑屏障,联合其他免疫疗法靶向肿瘤部位,或可为胶质瘤的免疫治疗带来新的方式。同时传统疗法联合新兴疗法也为胶质瘤免疫治疗带来了契机。
原文链接:https://link.springer.com/article/10.1186/s13046-022-02349-7